自然金(Au):所有的Au原子做立方最紧密堆积,晶胞为立方面心格子,立方对称。

图2-15 自然金(Au)的晶胞结构
NaCl晶体:Cl-离子做立方最紧密堆积,Na+离子充填于所有的八面体空隙中,立方对称。因为n个球形成的八面体空隙也为n个,所以阴、阳离子数量比为1:1。从图2-15 与2-16的对比也可以看出,自然金中Au原子的分布相当于NaCl结构中Cl-离子的分布,在NaCl结构中空隙里充填了Na+离子而自然金结构中的空隙没有其他原子充填。

图2-16 NaCl晶胞结构
金刚石(C):为典型的共价键晶体(原子晶格),所以不遵循最紧密堆积原理。每个C原子与周围另外四个C原子以sp3杂化轨道形成共价键;其晶胞也为立方面心格子,立方对称。
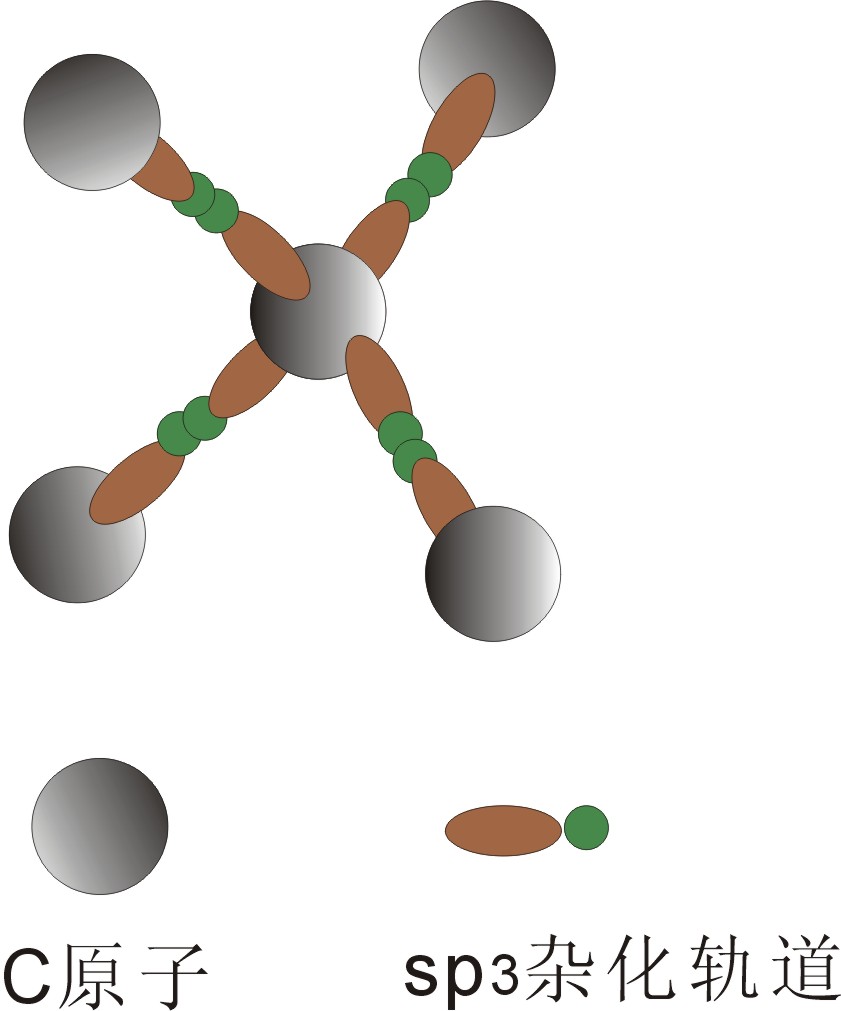
图2-17 金刚石中C-C之间sp3杂化轨道成键示意图
图2-18 金刚石晶胞结构
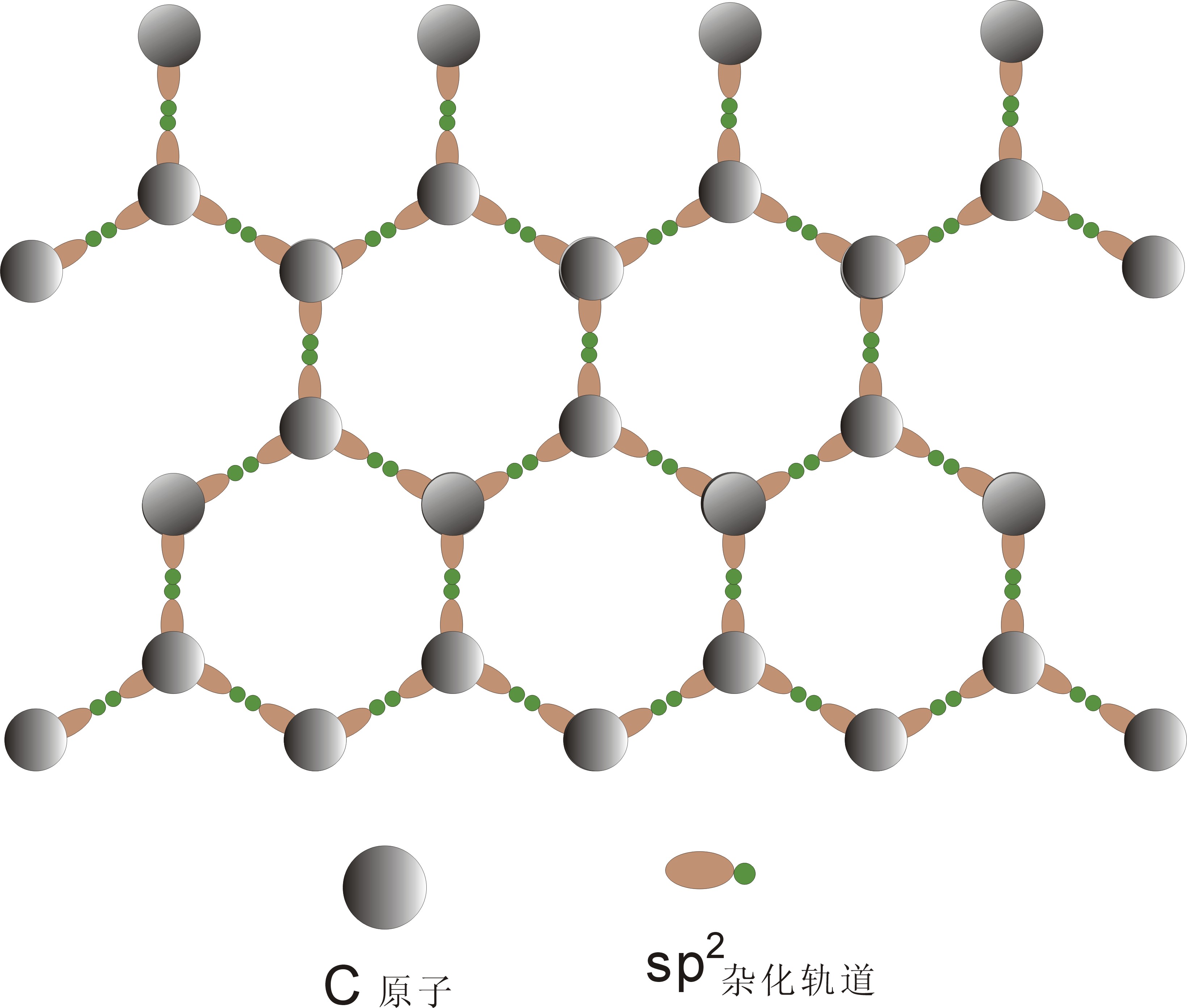
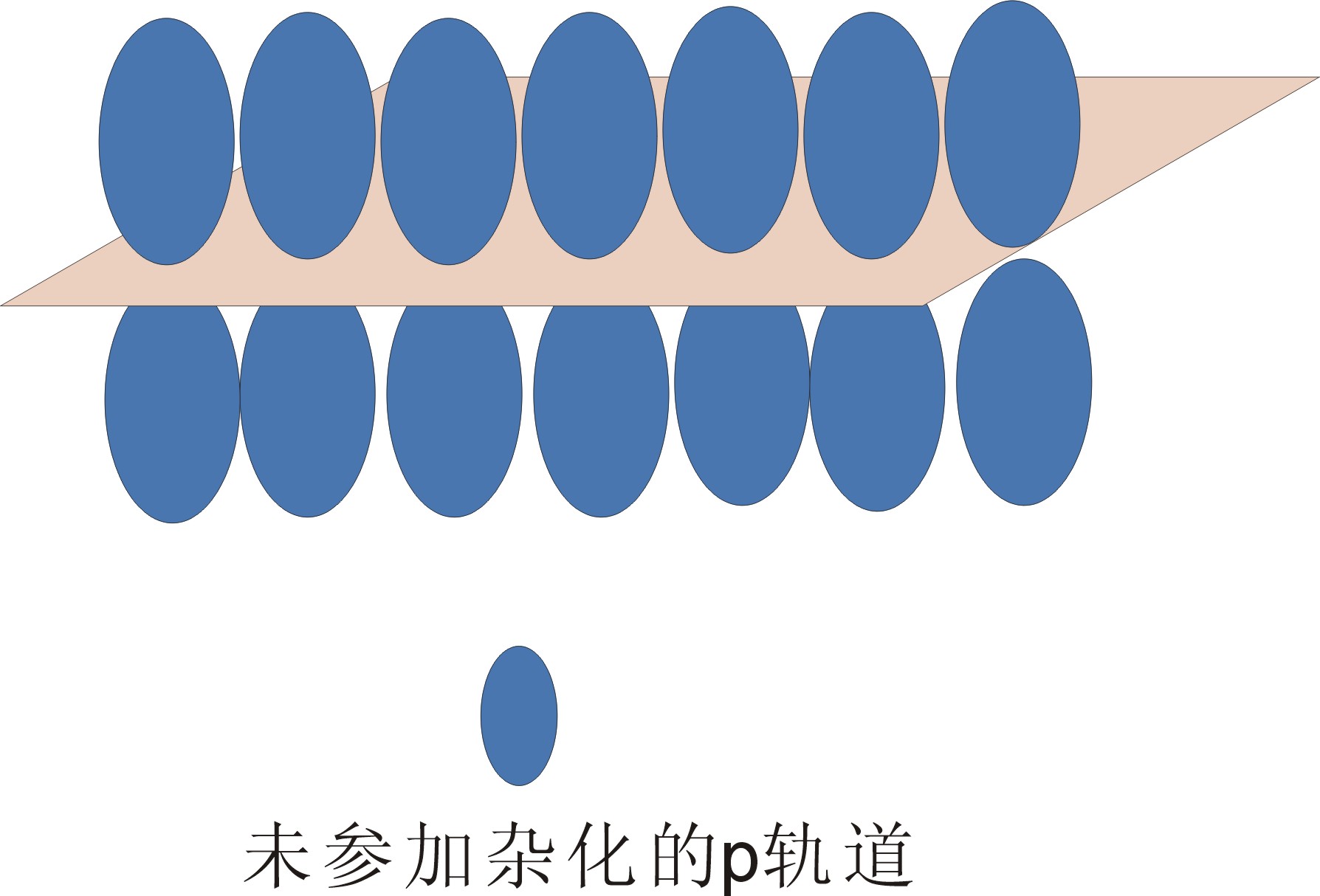
石墨(C):石墨与金刚石是C的两个同质多像(同素异形)变体。石墨结构中有共价键、分子键等,所以也不遵循最紧密堆积原理。石墨是一个典型的层状结构,层内每个C与周围三个C以sp2杂化轨道形成共价键,还有一个p轨道没有参加杂化,这些没有参加杂化的p轨道以垂直于层是方向平行排列,形成一个大p键(相当于金属键),层间还有分子键。
(a) (b)
图2-19 石墨晶体结构中化学键示意
(a) 石墨层内每个C原子以sp2杂化轨道与周围三个C原子形成共价键
(b) 未参加杂化的p轨道在垂直石墨层状结构的平面上“肩并肩”形成大p键

图2-20 石墨层状晶体结构
方解石(Ca[CO3]):晶体结构中存在[CO3]基团,为平面三角状,Ca2+与[CO3]2-的分布规律与NaCl结构中Na+和Cl-是一样的,只是将平面三角状的[CO3]2-取代Cl-,Ca2+取代Na+。所以,我们也称方解石的结构为NaCl结构的衍生结构。在NaCl结构中,离子排列是遵循紧密堆积原理的,而方解石也具有这种结构特点,由此可见,晶体结构中如果存在非球形的基团,也能遵循紧密堆积原理。
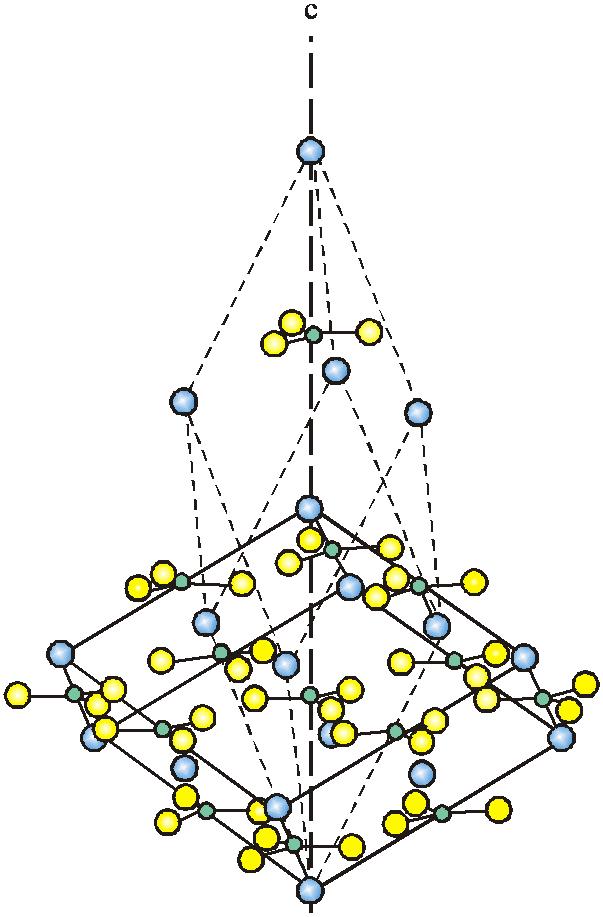
图2-21 方解石结构 (其中锐菱面体为方解石结构的晶胞,钝菱面体为与NaCl晶胞相应的范围)
由于方解石结构中存在[CO3]平面三角形,而且在结构中它们是平行排列的,所以导致方解石晶体在平行于[CO3]平面三角形方向上的折光率与垂直该方向的折光率相差很大,因此,方解石具有很大的双折率。
透明无色的方解石叫冰洲石,可做光学材料,下图表示的是冰洲石的高折光率。

图2-22 冰洲石的折光效应
石英(a-SiO2):结构中存在[SiO4]基团,为四面体形状,并且每个[SiO4]四面体与周围的四个[SiO4]四面体共用四个角顶连接,形成一个架状结构,架中有较大的空隙,结构没有达到紧密状态。从石英的结构可以得知,当结构中的基团与基团共用角顶连接时,基团不能自由活动,结构就不能达到最紧密状态。


(a) (b)
图2-23 石英的架状结构
(a) 沿Z轴往下看的结构图
(b) 将Z轴近于直立起来的结构图